Scopriamo come i carboidrati si trasformano in grassi e come avviene lo stoccaggio dei trigliceridi nei tessuti epatici e in quelli extraepatici. Infine, esploreremo in che modo i carboidrati si traformano in colesterolo.

Come si trasformano i carboidrati
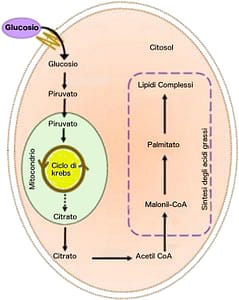
Dopo un pasto, tutto il cibo viene trasformato in glucosio, una fonte immediata di energia per le cellule del nostro organismo.
Il glucosio in eccesso viene immagazzinato nel fegato e nei muscoli sottoforma di glicogeno. Se queste riserve sono al completo, con l’aiuto dell’insulina il glucosio viene convertito in trigliceridi e poi immagazzinato sottoforma di acidi grassi nel tessuto adiposo.
Quando c’è sovrabbondanza di acidi grassi, questi si accumulano anche nel fegato.
I carboidrati si trasformano in grassi
In sintesi, ci sono due modi con cui i glucidi (carboidrati) interagiscono con il grasso corporeo depositato nei vari tessuti:
- sommandosi, sottoforma di acidi grassi, ai depositi di grasso esistenti,
- stimolando la produzione di insulina.
Nel primo caso si vanno a “gonfiare” gli adipociti. Nel secondo caso, l’insulina non aggiunge nulla agli adipociti di per sé, ma ostacola il rilascio degli acidi grassi immagazzinati.
Esiste un’altra modalità di accumulo adiposo: un processo chiamato de novo lipogenesi che trasforma i glucidi in grasso di deposito.
Questo processo è di norma piuttosto inefficiente nell’organismo1, il che suggerisce che i carboidrati non possono essere immagazzinati in grandi quantità sotto forma di grassi.
Tuttavia, in alcuni casi il processo di lipogenesi de novo può essere incrementato in due modi:
L’insulina è l’ormone del metabolismo glucidico che consente al glucosio di entrare nelle cellule e di essere bruciato ad un ritmo maggiore.
Questo non cambia il tasso metabolico complessivo (calorie bruciate nel corso di una giornata), ma l’insulina impedisce agli adipociti di liberarsi del grasso.
Quando l’insulina aumenta, i depositi di grasso corporeo sono stimolati ad assorbire i “pacchetti” di glucosio, che pertanto non può essere rilasciato per essere “bruciato”. Al suo posto verrà bruciato il glucosio di riserva: il glicogeno, presente in quantità limitate nei muscoli e nel fegato.
Questo spiega perché le persone in sovrappeso, diabetiche e obese, si sentono stanche pur mangiando carboidrati: maggiore è la quantità di tessuto adiposo, più efficiente è lo stoccaggio del glucosio negli adipociti, invece di essere utilizzato dai muscoli e dal cervello.
Va notato che il livello di insulina è finemente regolato. A seconda del livello di insulina, la perdita di grasso corporeo viene ostacolata in misura proporzionale.
Tale processo di regolazione non raggiunge mai gli estremi, 0% – 100%. In altre parole, c’è sempre un certo livello di utilizzo del grasso e del glucosio. La quantità di utilizzo di ciascuno di essi varia solo in risposta alla dieta e all’esercizio fisico.
Grasso corporeo e lipogenesi de novo
La maggior parte delle cellule può svolgere la funzione di lipogenesi de novo.
Nel tessuto adiposo umano, una maggiore espressione degli enzimi lipogenici (enzimi che sintetizzano acidi grassi) è associata ad una maggiore sensibilità all’insulina a prescindere dall’obesità6.
Steatosi epatica e diabete mellito
Tuttavia, se la lipogenesi de novo avviene nelle cellule epatiche allora gli effetti sono particolarmente dannosi, alimentando l’insulino-resistenza7, alti livelli ematici di trigliceridi, steatosi e steatopatie8.
La steatosi epatica è stata associata a un aumento dell’incidenza del diabete tipo 2.
De novo lipogenesi e fegato grasso
La combinazione di elevate concentrazioni plasmatiche di glucosio (iperglicemia) e di insulina (iperinsulinemia) favorisce la sintesi de novo degli acidi grassi (lipogenesi) e compromette la β-ossidazione, contribuendo così allo sviluppo della steatosi epatica9.
L’immagine sottostante mostra l’effetto sul fegato dell’insulino-resistenza.
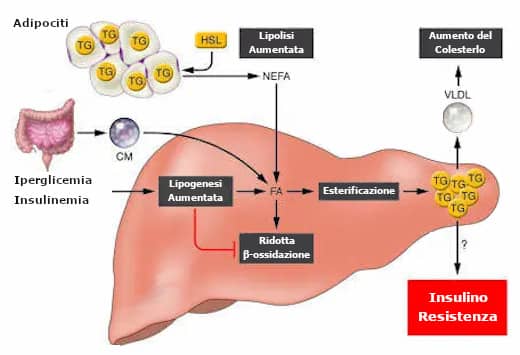
L’insulina non inibisce adeguatamente l’ ormono-sensibile o HSL (dall’inglese Hormone-sensitive lipase), quindi la nel tessuto adiposo bianco non viene soppressa.
Di conseguenza, i grassi periferici immagazzinati nei tessuti adiposi fluiscono al fegato sottoforma di acidi grassi non esterificati (NEFA=dall’inglese Non Esterified Fatty Acids).
Inoltre, arrivano al fegato anche gli acidi grassi alimentari attraverso l’assorbimento dei chilomicroni (CM) di derivazione intestinale.
Lo stato di attività della lipogenesi de novo viene rilevata misurando una serie di acidi grassi tra cui il palmitico e lo sterico.
Dopo aver visto il meccanismo con cui i carboidrati si trasformano in grassi, vediamo il collegamento con la sintesi di colesterolo.
I carboidrati si trasformano in colesterolo
L’eccesso di carboidrati e la resistenza all’insulina costituiscono anche il maggior stimolo alla sintesi di colesterolo.
I farmaci anticolesterolo favoriscono la resistenza all’insulina e aggravano le condizioni sia dei sani che di quelli affetti da diabete e sindrome metabolica. Dabhi e colleghi hanno chiarito il meccanismo biochimico di questo fenomeno10.
La biosintesi di colesterolo è complessa e lo costituisce di una struttura biochimica più simile a una cera che a un grasso (benché sia definito tale), oltre a differenziarlo dai trigliceridi e dai fosfolipidi1112.
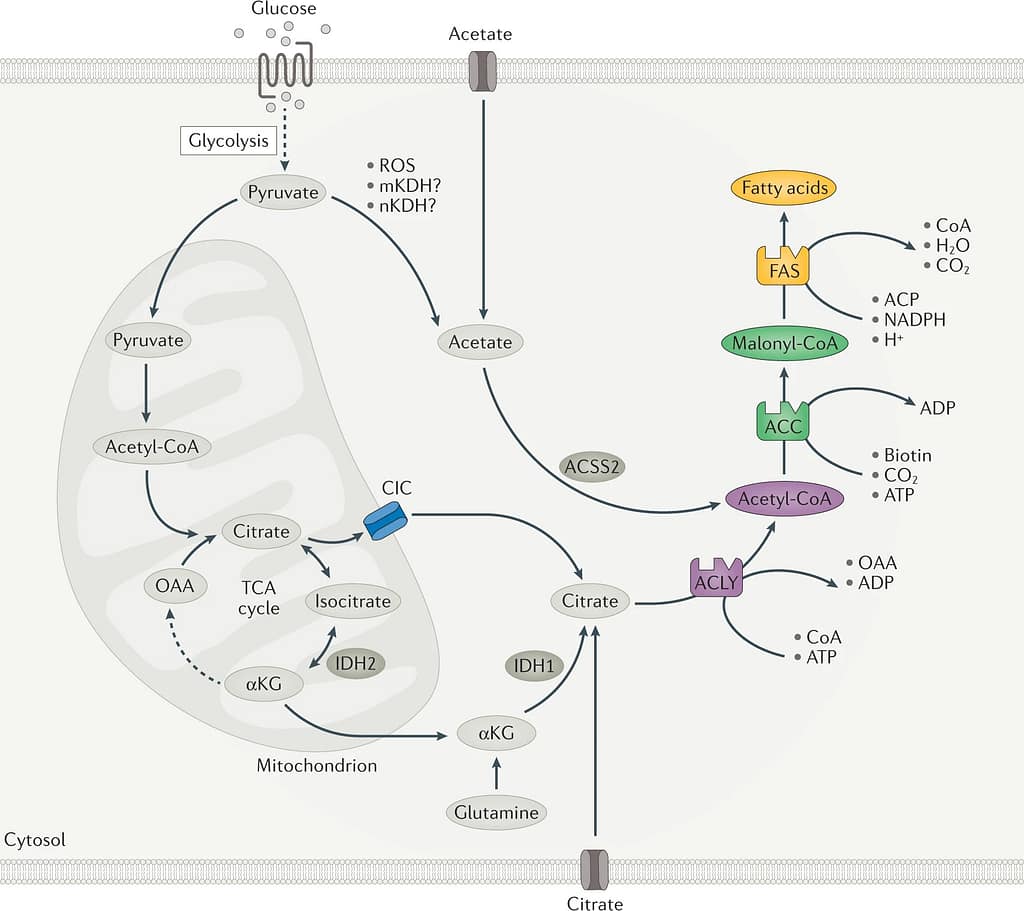
Nonostante la sua particolare struttura, il colesterolo deriva dalla stessa via nella quale i carboidrati si trasformano in grassi.
In particolare, l’ATP citrato liasi (ACLY) è l’enzima che collega il metabolismo dei carboidrati a quello dei lipidi, generando acetil-CoA dal citrato per la biosintesi di acidi grassi e di colesterolo.
Per concludere
Dagli studi evidenziati emerge con chiarezza che lo stimolo maggiore alla sintesi endogena di grassi e colesterolo proviene dall’insulina e dunque dai carboidrati assunti nella dieta.
Pertanto, ridurre uova e grassi in caso di ipercolesterolemia è in sostanza un’indicazione errata. Approfondimento sulle cause di ipercolesterolemia e i fattori di rischio cardiovascolare più significativi.
In una dieta low-carb, la restrizione glucidica modifica le particelle più dense e più piccole del colesterolo LDL, facendole diventare più grandi e meno aterogene, migliorando in tal modo la qualità del profilo lipidico1314.